Según dos estudios, parece que la pérdida de información epigenética puede impulsar el envejecimiento y que su restauración puede revertirlo.
|
Como el lector de esta web bien sabe, desde hace ya bastante años se está investigando en cómo alargar la vida y reducir los síntomas de la vejez, aunque hasta el momento no hay ningún tratamiento al respecto. En los últimos días se han publicado estudios en los que se cuentan nuevos avances.
Un estudio internacional de 13 años dirigido por David Sinclair (Escuela de Medicina de Harvard), realizado sobre ratones y que todavía está en desarrollo, demuestra por primera vez que la degradación en la forma en la que se organiza y regula el ADN, conocida como epigenética, puede provocar el envejecimiento en un organismo, independientemente de los cambios en el ADN en sí.
El trabajo muestra que fallos en la información epigenética hace que los ratones envejezcan y que restaurar la integridad del epigenoma revierte esos signos de envejecimiento.
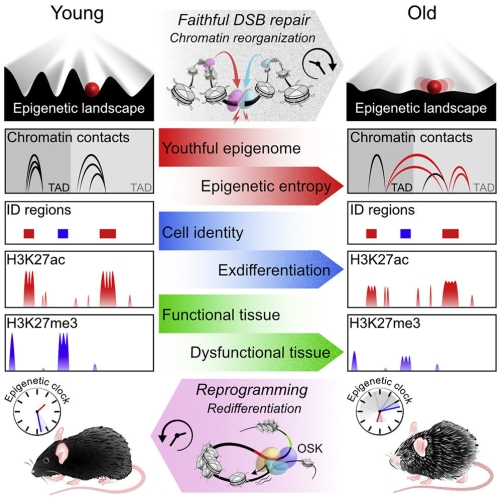
Todas las células de nuestro cuerpo contienen el genoma al completo. Pero no todo ese ADN es leído en una célula dada. El ADN no está aislado, sino que forma parte de la cromatina, que es el complejo de ADN y proteínas que forman los cromosomas. Hay estructuras físicas a escala molecular, como las histonas, que agrupan partes del ADN de una forma compactada que impide su lectura y desenrollan porciones de ese ADN cuando es necesario. Los genes son inaccesibles cuando están agrupados, pero están disponibles para ser copiados y utilizados para producir proteínas cuando están desenrollados. Por lo tanto, los factores epigenéticos regulan qué genes están activos o inactivos en una célula determinada en un momento dado.
Las moléculas epigenéticas, al actuar como un interruptor para la actividad de los genes, ayudan a definir el tipo y la función celular. Dado que cada célula en un organismo que tiene básicamente el mismo ADN, es el encendido y apagado de genes particulares lo que diferencia una célula nerviosa de una célula muscular o de una célula pulmonar.
Hasta ahora se creía que eran las mutaciones en el ADN las únicas responsables del envejecimiento que, con el tiempo, hacen que más y más genes funcionen incorrectamente. Estos fallos de funcionamiento, a su vez, hacen que las células pierdan su identidad, por lo que los tejidos y los órganos se deterioren, lo que lleva a la enfermedad y, en última instancia, a la muerte.
Sin embargo, los experimentos realizados por este equipo proporcionan la confirmación largamente esperada de que los cambios en el ADN no son la única, ni siquiera la principal, causa del envejecimiento. En su lugar, los hallazgos muestran que los cambios químicos y estructurales en la cromatina provocan el envejecimiento sin alterar el genoma en sí.
«Esperamos que los hallazgos transformen la forma en que vemos el proceso de envejecimiento y la forma en que abordamos el tratamiento de las enfermedades asociadas con el envejecimiento», dijo el coautor principal Jae-Hyun Yang.
Es más fácil manipular las moléculas que controlan los procesos epigenéticos que revertir las mutaciones del ADN, por lo que el trabajo apunta a nuevas vías para prevenir o tratar el daño relacionado con la edad que se enfoquen en la epigenética en lugar de en la genética.
Obviamente, antes de tratar a humanos, los resultados ahora demostrados en ratones deben replicarse en mamíferos más grandes y en voluntarios humanos. Actualmente se están realizando ya estudios en primates no humanos.
«Esperamos que estos resultados se vean como un punto de inflexión en nuestra capacidad para controlar el envejecimiento. Este es el primer estudio que muestra que podemos tener un control preciso de la edad biológica de un animal complejo, que podemos hacerlo avanzar y retroceder a voluntad», dice Sinclair.
La hipótesis de las mutaciones como causa del envejecimiento empezó a tener problemas cuando, hace ya años, algunos investigadores encontraron que ciertos humanos y ratones con altas tasas de mutación no mostraban signos de envejecimiento prematuro. Otros observaron que muchos tipos de células envejecidas tienen pocas mutaciones o ninguna.
Así que los investigadores comenzaron a preguntarse qué más habría, además de las mutaciones, que causara el envejecimiento. Fue haciéndose una lista de posibles culpables y entre ellos estaban los cambios epigenéticos.
A fines de la década de 1990 y principios de la de 2000, diversos grupos de investigación demostraron en levaduras y mamíferos que los cambios epigenéticos acompañan al envejecimiento. Sin embargo, no pudieron decir si estos cambios impulsaban el envejecimiento o eran una consecuencia de él.
No fue hasta el estudio actual que el equipo de Sinclair pudo aclarar que los cambios genéticos son los culpables gracias a un conjunto de experimentos.
El experimento principal del equipo involucró la creación de cortes temporales de reparación rápida en el ADN de ratones de laboratorio. Esto lo hicieron administrando un fármaco en particular que produce una enzima que corta su ADN en 20 sitios del genoma y que luego se reparan fielmente. Estas rupturas imitan las rupturas continuas de baja gravedad en los cromosomas que las células de los mamíferos experimentan todos los días en respuesta a cosas como la respiración, la exposición a la luz solar y los rayos cósmicos y el contacto con ciertas sustancias químicas. Para poner a prueba si el envejecimiento es el resultado de este proceso, los investigadores aceleraron el proceso para así simular la vida en avance rápido.
El equipo también se aseguró de que la mayoría de las rupturas no se produjeran dentro de las regiones codificantes del ADN de los ratones, los segmentos que forman los genes. Esto evitó que los genes de los animales desarrollaran mutaciones. En cambio, las rupturas alteraron la forma en que se pliega el ADN.
Sinclair y sus colegas llamaron a su sistema CIE, siglas de cambios inducibles en el epigenoma.
Al principio, los factores epigenéticos detuvieron su trabajo normal de regular los genes y se trasladaron a las rupturas del ADN para coordinar las reparaciones. Posteriormente, los factores regresaron a sus ubicaciones originales. Pero con el paso del tiempo, las cosas cambiaron. Los investigadores notaron que estos factores se «distraían» y no volvían a su lugar de origen después de reparar las roturas. El epigenoma se desorganizó y comenzó a perder su información original. La cromatina se condensó y se desenrolló en patrones incorrectos, un sello distintivo del mal funcionamiento epigenético.
A medida que los ratones perdían su función epigenética juvenil, comenzaron a verse y actuar como si fueran viejos. Los ratones terminaron con una salud deteriorada. En cuestión de semanas, perdieron cabello y pigmentación. En cuestión de meses mostraron múltiples signos de fragilidad y envejecimiento de los tejidos. Además, los investigadores vieron un aumento en los biomarcadores que indican el envejecimiento. Las células perdieron sus identidades como, por ejemplo, células musculares o de la piel. La función del tejido se altero y los órganos fallaron.
El equipo usó una herramienta reciente desarrollada por su laboratorio para medir «biológicamente» la edad de los ratones en función de cuántos sitios del genoma perdieron los grupos metilo que normalmente tenían. En comparación con los ratones no tratados nacidos al mismo tiempo, los ratones CIE habían envejecido significativamente más.
Luego, los investigadores administraron a los ratones una terapia génica que revirtió los cambios epigenéticos que habían causado. Según Sinclair, fue como reiniciar una computadora que funcionaba mal.
Para la terapia se usó un cóctel molecular llamado OSK que son genes que están activos en las células madre y pueden ayudar a rebobinar las células maduras a un estado anterior. Ya se usó esta misma terapia para restaurar la visión en ratones ciegos en 2020. Se usaron adenovirus que portaban genes para tres de los factores de Yamanaka: Oct4, Sox2, Klf4 y que se conocen colectivamente como OSK.
La terapia puso en marcha un programa epigenético que llevó a las células a restaurar la información epigenética que tenían cuando eran jóvenes, siendo este arreglo permanente. Entonces, los órganos y tejidos de los ratones CIE recuperaron un estado juvenil. Aún no se sabe cómo el tratamiento OSK logró este resultado.
Los análisis de los músculos, los riñones y las retinas de los ratones sugieren que el tratamiento revirtió algunos de los cambios epigenéticos inducidos por las rupturas del ADN.
Según Sinclair, el descubrimiento respaldaría la hipótesis de que las células de los mamíferos mantienen una especie de copia de seguridad epigenética que, cuando se accede, puede permitir que una célula envejecida y alterada epigenéticamente se reinicie a un estado saludable y juvenil.
El método CIE ofrece a los investigadores una nueva forma de explorar el papel de la epigenética en el envejecimiento y otros procesos biológicos. Debido a que los signos de envejecimiento se desarrollaron en los ratones CIE después de solo seis meses en lugar de hacia el final del promedio de vida de los ratones de dos años y medio, el enfoque puede ahorrar tiempo y dinero a los investigadores que estudian el envejecimiento.
Los investigadores también pueden mirar más allá de la terapia génica OSK al explorar cómo se puede restaurar la información epigenética perdida en organismos envejecidos.
Sinclair espera que el trabajo inspire a otros científicos a estudiar cómo controlar el envejecimiento para prevenir y eliminar las enfermedades y afecciones relacionadas con la edad en los humanos, como las enfermedades cardiovasculares, la diabetes tipo 2 o la neurodegeneración. «Todas estas son manifestaciones del envejecimiento que hemos estado intentando tratar con medicamentos cuando surgen, que es casi demasiado tarde», sostiene.
El objetivo final sería abordar las causas fundamentales del envejecimiento para extender la duración de la salud humana: la cantidad de años que una persona permanece no solo viva sino sana.
Las aplicaciones médicas están muy lejos y requerirán de extensos experimentos en múltiples modelos celulares y animales. Pero, según Sinclair, los científicos deberían pensar en grande y seguir intentándolo para lograr esos sueños.
«Estamos hablando de tomar a alguien que es viejo o está enfermo y hacer que todo su cuerpo o un órgano específico vuelva a ser joven, para que la enfermedad desaparezca. Es una gran idea. No es la forma en que solemos hacer medicina», finaliza.
Uno de los problemas de este resultado es que no está claro lo bien que estas roturas de ADN inducidas imitan a los animales que envejecen naturalmente, pues el envejecimiento es un proceso complejo con múltiples factores que contribuyen a él.
Un segundo estudio realizado por otro grupo de investigadores también ha tenido un éxito en este campo. Aunque modesto, sus resultados se basan en ratones envejecidos de formar natural durante 124 semanas. La administración a estos ratones ancianos de un cóctel de proteínas (factores de Yamanaka) logró extender modestamente su vida.
Los análisis revelaron que los factores de Yamanaka parecían haber restaurado parte del epigenoma de los animales. Además, estos animales vivieron otras 18 semanas en promedio, en comparación con las 9 semanas del grupo de control. También recuperaron parcialmente los patrones de metilación del ADN, un tipo de marca epigenética, típica de los animales más jóvenes. Aunque algunos estudios han sugerido que los factores de Yamanaka pueden facilitar la aparición del cáncer, estos investigadores dicen que, hasta ahora, no han encontrado efectos negativos obvios en ratones que recibieron la terapia génica.
Obviamente será necesario replicar estos resultados y explorar mejor el mecanismo antes de que se pueda afirmar que estas terapias funcionan. Estos estudios usan factores de reprogramación para revertir los cambios epigenéticos que ocurren durante el envejecimiento, pero eso está lejos de hacer que un animal viejo vuelva a ser joven, así sin más.
Copyleft: atribuir con enlace a https://neofronteras.com [1]
Fuentes y referencias:
Artículo original. [2]
Preprint en BiorXiv. [3]
Esquema: Cell (2023). DOI: 10.1016/j.cell.2022.12.027.