|
|
|
Los huesos del esqueleto regulan, al menos parcialmente, el metabolismo del azúcar en el cuerpo. Con esto se añade una función más a las muchas que realizan los huesos y se abren nuevas vías para el tratamiento de la diabetes de tipo II.
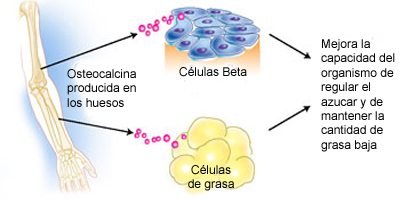
En el cuerpo humano hay 206 huesos. Su función más obvia es la estructural, es decir, dar soporte a los músculos y órganos del cuerpo. Los huesos están vivos y constantemente se reconstruyen a sí mismos, y producen células sanguíneas en sus médulas. Pero ahora se ha descubierto que tienen una función antes desconocida: pueden actuar como un órgano endocrino que regula el metabolismo energético, jugando un papel en la pérdida y ganancia de peso mediante la regulación hormolanl de la glucosa. Al parecer los huesos segregan osteocalcina, una hormona que aumenta la actividad de la insulina, reduce la obesidad y disminuye el riesgo de padecer diabetes de tipo II en ratones.
El autor del trabajo publicado en Cell es Gerard Karsenty de Columbia University Medical Center en Nueva York.
Karsenty y sus colaboradores decidieron explorar las capacidades endocrinas de los huesos después de descubrir que la leptina producida por las células grasas regulaba la masa ósea. Pretendían comprobar la hipótesis contraria de que las células de los huesos regulaban las células de grasa.
Sabían que los huesos segregaban osteocalcina, que ayuda a agregar el calcio en los huesos, pero nadie había visto que esta molécula cumpliera otras funciones en el organismo por lo que no se le había clasificado de hormona.
Sin embargo, observaron que los ratones con bajos niveles de osteocalcina terminaban obesos, sugiriendo que debía de haber alguna relación.
Decidieron manipular genéticamente ratones de laboratorio para exploraron este asunto. Pretendían estudiar los genes activos en las células de los huesos que además estaban relacionados con el metabolismo de la glucosa. Inactivando estos genes en ratones de laboratorio descubrieron que los animales que tenían la producción de ostecalcina genéticamente bloqueada terminaban siendo obesos y desarrollaban intolerancia a la glucosa, condiciones previas al desarrollo de diabetes, pese a haber seguido una dieta normal e igual a la de los ratones de referencia.
Más tarde descubrieron que la osteocalcina indica a las células de grasa a producir adiponectina, una hormona que aumenta la sensibilidad a la insulina. Por tanto demostraron que las células óseas se comunican con las células de grasa mediante este sistema.
Además vieron que la osteocalcina dispara la producción de más células beta pancreaticas, que son las que producen la insulina, aumentando con ello la producción de la misma.
Según los investigadores estas dos propiedades simultáneas no son habituales. Es raro que una hormona simultáneamente aumente la producción de insulina y su sensibilidad. Esperan que un día se pueda usar la osteocalcina para el tratamiento de la diabetes de tipo II. Ésta ayudaría al paciente a fabricar más insulina y a hacer un mejor uso de ella. Los medicamentos que hay hoy en día para tratar esta enfermedad operan solamente en una de las formas.
La pregunta del millón es saber si estos resultados se podrán reproducir en humanos. Aunque de esto nunca se está seguro al cien por cien, los investigadores se muestran esperanzados de que esto sea así, porque el metabolismo mediado por la insulina en humanos y ratones es muy similar y se ha podido comprobar que los pacientes con diabetes de tipo II tienen además bajos niveles de osteocalcina.
La diabetes de tipo II es una variedad de diabetes asociada con la obesidad y la vida sedentaria y su incidencia se multiplicado en los últimos años en los países avanzados. Actualmente, por ejemplo, afecta al 7% de la población de EEUU.
Fuentes y referencias:
Nota de prensa de Columbia University. [1]
Karsenty, G. et al. Cell Metabolism 4, 341-348 (2006).
Lee, N. K. et al. Cell 130, 456-469 (2007).