Investigan en baterías que usen sodio en lugar de litio y fibras de madera en el ánodo.

|
El descubrimiento de la tabla periódica de los elementos supuso un hito para la Química y para la ciencia en general. Nos permite comprender las propiedades de los elementos de una manera sencilla y elegante. Su plena justificación fue posible gracias a la Mecánica Cuántica, que permite explicar su estructura a partir de las propiedades de los electrones que rodean al núcleo.
Es básicamente una cuadrícula estructurada en una serie de “filas” o periodos y por “columnas” o grupos. Los grupos crean familias de elementos con propiedades similares. Así por ejemplo el helio, neón, argón, criptón, xenón y radón (He, Ne, Ar, Kr, Xe y Rn) son los gases nobles y todos están en la misma columna. Todos los elementos que están en una misma columna tienen propiedades químicas similares (pero no idénticas), cuanto más cercanos estén serán más parecidos.
Cuando la evolución biológica descubrió la fotosíntesis lo hizo a partir del sulfuro de hidrógeno o SH2 en lugar de usar agua o H2O. Las bacterias púrpuras del azufre dividen el sulfuro en hidrógeno y azufre a partir de la energía del sol de una manera similar a como las plantas dividen el agua en oxígeno e hidrógeno. En ambos casos usan el hidrógeno para crear moléculas orgánicas y se desprende azufre en el primer caso y oxígeno en el segundo. Cuando el aporte de sulfuro de hidrógeno empezó a escasear en la Tierra primitiva la evolución no tuvo más remedio que modificar la fotosíntesis y echar mano del agua en su lugar. Con ello la fotosíntesis simplemente se movía en la tabla periódica hacia arriba, del azufre al oxígeno. Quizás hay alguna forma de vida en el Universo cuya fotosíntesis desprenda selenio.
Esta química similar de los elementos situados en el mismo grupo también nos juega mala pasadas. El arsénico está justo por debajo del fósforo y, por tanto, produce una química similar, pero no idéntica. La bioquímica celular de todos los organismos terrestres usa fósforo, pero no arsénico, si lo ingerimos interfiere con esa química y el resultado es que nos envenenamos. Se ha propuesto una bioquímica alternativa basada en arsénico en lugar de fósforo en algún planeta desconocido e incluso se informó que habían conseguido seleccionar unas bacterias terrestres que lograban incorporar este elemento, pero el resultado parece que ha quedado en anda.
Si nos movemos al grupo de los alcalinotérreos vemos que el calcio está justo por encima del estroncio. Cuando hay un accidente en una planta nuclear se libera estroncio radiactivo al medio y este se puede usar en lugar del calcio en nuestros huesos, por lo que nos volvemos radiactivos y morimos.
La columna en la que está el grupo de los metales alcalinos es divertida. Además del hidrógeno nos encontramos con litio, sodio, potasio, rubidio, cesio y francio. Son metales con aspecto plateado (salvo el hidrógeno), sobre todo si se cortan. Pero son tan reactivos que en seguida pierden ese brillo. Puede ser divertido arrojar un trocito de sodio o potasio en agua, o espolvorear algo de potasio sobre una llama y ver el color que desprende (aunque generalmente está tan contaminado por sodio, debido precisamente a sus propiedades similares, que sólo se ve un amarillo aburrido).
Todo esto viene a cuento acerca de una pregunta que nos podemos plantear. Si el sodio es mucho más abundante y accesible que el litio, ¿por qué no hacemos nuestras baterías con sodio en lugar de con litio? Serían mucho más baratas y podrían emplearse para hacer de las fuentes de energía alternativas algo mucho más fiable.
El problema es que los iones de sodio son bastante más grandes que los de litio y gradualmente dañan el ánodo de la batería según se difunden durante los ciclos de carga y descarga. Además si se usa un ánodo de estaño la batería tendrían una alta capacidad de carga, pero el sodio y el estaño se combinan y hacen hincharse el ánodo, lo que acelera la pulverización estructural de la batería. Como resultado una batería de sodio con ánodo de estaño sólo aguanta 20 ciclos de carga.
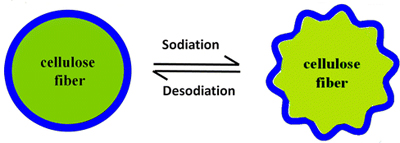
Para solucionar este problema Hongli Zhu y sus colaboradores de la Universidad de Maryland pensaron en usar un material poroso que permita el trasiego de estos iones: fibra de madera. En la madera se pueden encontrar conductos recubiertos de lignina que sirven para llevar agua y minerales por el tronco. Así que estos investigadores tomaron unas fibras de este tipo de 2500 nm de longitud y las recubrieron con una capa de 50 nm de estaño. Usando estas fibras como ánodo en una batería de sodio lograron que aguantara 400 ciclos de carga.
|
Las fibras de madera son lo suficientemente flexibles como para aguantar el estrés mecánico que pulveriza otro tipo de diseños de ánodo. Además las fibras de madera son fáciles y baratas de procesar y, por tanto, según los investigadores, se podrían crear baterías de sodio de bajo coste.
Ahora el equipo quiere mejorar la idea y aplicarla a baterías de mayor tamaño, supuestamente para su uso el almacenamiento de electricidad procedente de fuentes renovables. Pero no será fácil ni rápido llegar hasta el prototipo comercial.
En todo caso el resultado nos ha servido para repasar un poco la tabla periódica de los elementos y quizás aprender algo.
Copyleft: atribuir con enlace a http://neofronteras.com/?p=4139 [1]
Fuentes y referencias:
NewScientist.
Artículo original. [2]