Hallan cómo el mal funcionamiento la proteína WRN altera la estructura de la heterecromatina del ADN y de cómo esto acelera el envejecimiento en el síndrome de Werner.
|
|
|
En la película Blade Runner uno de los personajes (J.F. Sebastian) envejece más rápido de lo normal debido a una rara enfermedad genética. Otros de los personajes, los replicantes, están diseñados para vivir sólo unos pocos años.
La película trata de un futuro distópico dominado por grandes corporaciones, en donde la policía es omnipresente y hay abuso de poder sobre el individuo. Pero también trata de la mortalidad y de lo que supone ser consciente ello.
Tenemos un tiempo de vida asignado que es limitado. Puede que muramos con 20 años debido a un accidente al practicar un deporte de riesgo o a los 90 años de edad, ya viejos y decrépitos. Entre medias hay toda una suerte de modos de morir, algunos de ellos mediados por enfermedades terribles. Normalmente escogemos vivir tratando de olvidar todo esto, lo que muchas veces nos impide vivir plenamente.
Lo que sí está claro es que a nadie le gusta morirse y que nos gustaría vivir más tiempo, aunque eso signifique que también lo hagan dictadores crueles, políticos corruptos, banqueros y “empresaurios” explotadores.
La búsqueda de la fuente de la eterna juventud sólo permitió descubrir la Florida en el pasado, pero ahora sí se está avanzando bastante en este campo, como muy bien hemos podido ver en NeoFronteras estos años. No se espera encontrar la inmortalidad, sino alargar mucho más la vida humana y que esta sea lo más sana posible. Ya se ha conseguido que las levaduras, nematodos, moscas de la fruta y ratones vivan más usando diversos métodos.
Posiblemente no hay barreras biológicas insalvables que impidan llegar a esta meta. Sobre esas barreras se trabaja ahora mismo, pero no es fácil y se requiere mucho esfuerzo investigador.
Puede que en un futuro distante los seres humanos vivan varios siglos y tengan pena de esos pobres de principios del siglo XXI que vivían mucho menos.
Pero esos mismos humanos que dicen amar la vida desprecian la vida de sus semejantes y la de los otros seres con los que comparten la biosfera. La mayoría de las veces no llegamos a tener un acto de humanidad como el de Roy Batty hacia el final de Blade Runner.
Así que puede que no alcancemos ese futuro idílico de seres cuasi-inmortales, sino un mundo distópido y apocalíptico en el que hemos destruido todos los ecosistemas o incluso el propio planeta. En un mundo madmaxista no cabe la investigación biomédica avanzada, ni tampoco la civilización que permita la ciencia y alcanzar la pseudo-imortalidad. Puede que, en nuestra pelea por unos recursos cada vez más escasos, nos exterminemos definitivamente con toda una suerte de caro material bélico. No importa, en unos 50 millones de años la Tierra se recuperará y volverá a ser el vergel que fue, aunque sin nadie que pueda contemplar su belleza.
La enfermedad de Sebastian que es descrita en la película se parece mucho al síndrome de Werner. Este síndrome consiste en un desorden genético que hace que las personas que lo padecen envejezcan más rápidamente de lo normal. Afecta a una de cada 200.000 personas en EEUU. Estas personas sufren de enfermedades relacionadas con el envejecimiento antes que las demás personas, como diabetes de tipo 2, cataratas, arteriosclerosis, osteoporosis, cáncer, etc. La mayoría de ellos muere alrededor de los 50 años.
La enfermedad está causada por una mutación del gen conocido como WRN, gen que genera la proteína WRN.
En estudios realizados hasta el momento se mostró que la forma normal de esta proteína es una enzima que mantiene la estructura e integridad del ADN de la persona. Cuando la proteína está mutada para causar el síndrome de Werner se dificulta la replicación y reparación del ADN, además de la expresión de genes. Se cree que esto es lo que provoca el envejecimiento prematuro, pero no estaba claro exactamente cómo la proteína WRN mutada alteraba estos procesos tan críticos.
Ahora, un estudio realizado por investigadores del Instituto Salk y de la Academia China de Ciencias ha encontrado cómo la mutación de este gen provoca el deterioro del ADN. En concreto ha encontrado qué deteriora la heterecromatina del ADN.
El estudio de este tipo procesos podría permitir avanzar en la lucha de enfermedades ligadas al envejecimiento, como la diabetes o el Alzheimer.
Puede que gracias es este descubrimiento, al uso de células madre y a la edición de ADN humano (ahora en las noticias) se pueda luchar no solamente contra el deterioro de la heterecromatina en esta enfermedad, sino, además, contra los procesos ligados al envejecimiento en general.
La mutación que causa este síndrome desorganiza la heterocromatina y esto altera el normal empaquetado del ADN, que es clave en el envejecimiento. Si se lograra identificar el mecanismo central de esta desorganización se podría intentar revertir el este proceso y, por tanto, el envejecimiento.
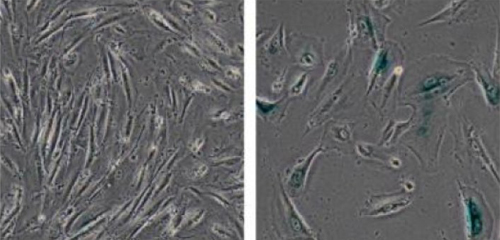
Estos investigadores querían buscar cómo la proteína WRN mutada causaba los problemas, así que crearon un modelo celular de laboratorio para el síndrome de Werner eliminando este gen en células madre humanas, lo que imitaba la mutación genética que causa el síndrome si se asumía que la WRN mutada era completamente afuncional. Esto les permitió estudiar rápidamente el proceso de envejecimiento celular en laboratorio (ver foto).
Vieron que este proceso alteraba la estructura de la heterocromatica, que son densos paquetes de ADN nuclear. Estos paquetes actúan como sistemas de activación de genes y dirigen la compleja maquinaria molecular de la célula. En los bordes de los paquetes de heterocromatina hay marcadores químicos, conocidos como etiquetas epigenéticas, que controlan la propia estructura de la heterocromatina. La alteración de estos interruptores puede cambiar la arquitectura de la heterocromatina, haciendo que o bien los genes se expresen (se traduzcan a proteínas) o sean silenciados.
Comprobaron que la eliminación del gen WRN derivaba en una desorganización de la heterocromatina, lo que apunta a un papel muy importante de la proteína WRN sana a la hora de mantener la integridad de la heterocromatina.
En experimentos posteriores mostraron que, efectivamente, la proteína interaccionaba directamente con las estructuras moleculares conocidas por estabilizar la heterocromatina.
Todo esto sugiere que la acumulación de alteraciones en la estructura de la heterocromatina juega un importante papel en el envejecimiento celular, lo que hace preguntarse si estas alteraciones pueden ser invertidas, algo que produciría un retroceso de las enfermedades asociadas al envejecimiento y un retraso del propio envejecimiento.
Obviamente se necesitan realizar más estudios sobre el asunto para comprender mejor el papel de la heterocromatina en el proceso de envejecimiento, incluido cómo interacciona con otros procesos celulares que también están implicados en el envejecimiento, como el acortamiento de los telómeros.
Este grupo de investigadores está ya desarrollando una técnica de edición epigenética para invertir las alteraciones epigenéticas que tienen papel en el envejecimiento humano y las enfermedades ligadas a él.
Copyleft: atribuir con enlace a http://neofronteras.com/?p=4661 [1]
Fuentes y referencias:
Artículo original [2]