Visualizan los orbitales atómicos
Consiguen visualizar los orbitales atómicos de átomos de hidrógeno excitados.

|
Cuando se es estudiante a veces se requiere ciertas dosis de fe, pues el alumno no puede repetir cada uno de los experimentos que han llevado a las diversas teorías científicas. En el laboratorio puede realizar parte de esos experimentos, generalmente los más sencillos, pero no los más complicados.
Al final el estudiante tiene que terminar creyendo en la buena fe de la comunidad científica y admitir que los átomos, por ejemplo, existen.
Cuando se propuso la teoría del átomo probablemente nunca se pensó que en algún momento los pudiéramos ver. La existencia de los átomos era inferida a partir de los experimentos de Química. Saber sobre su estructura fue más complicado pues requirió lanzar partículas alfa y contabilizar las que rebotaban, aquellas que habían chocando contra un núcleo de oro.
Más tarde se desarrolló la Mecánica Cuántica y con ella se logró explicar la estructura atómica, incluso cómo se organizaban los electrones del átomo. Las órbitas de tipo planeta que hasta entonces se habían imaginado para los electrones del átomo pasaron a ser orbitales, regiones del espacio en donde era más probable encontrar al electrón correspondiente. Algunos de esos orbitales eran esféricos, pero otros tenían forma lobulada. No dejaba de ser una forma curiosa.
Al final los microscopios electrónicos de cientos de kilovoltios lograron resolver átomos en ciertos materiales, por lo que el átomo dejó de ser algo que se imaginaba. El microscopio de efecto túnel también fue capaz de resolver átomos y las densidades de probabilidad de electrones superficiales. Pero pensar que algún día se lograría ver algo tan etéreo como los orbitales era algo, como mínimo, muy optimista.
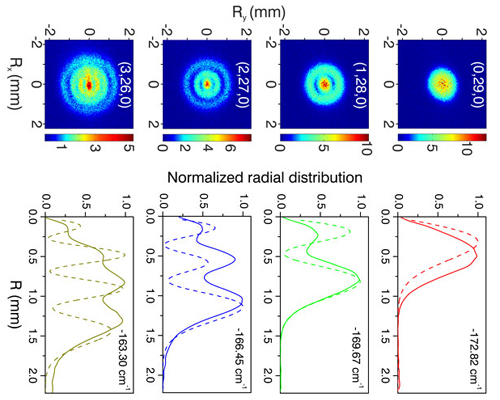
Pues bien, ya se ha conseguido visualizar directamente orbitales atómicos, en concreto los del hidrógeno excitado. Se ha conseguido gracias la técnica de microscopio de foto-ionización que se propuso por primera vez hace 30 años. Esta técnica permite visualizar la distribución de carga electrónica en el átomo y la estructura nodal de los orbitales excitados. Los microscopios de efecto túnel no permiten ver la estructura nodal “interior”, sino solamente la distribución de carga exterior, generalmente de los átomos de la superficie a estudiar.
Como ya sabemos, en Mecánica Cuántica (MC) no hay puntitos llamados electrones que estén perfectamente localizados. Según el principio de incertidumbre no se puede conocer a la vez la posición de una partícula y su cantidad de movimiento. En MC nos tenemos que conformar muchas veces con saber probabilidades. Esa probabilidad se calcula a través de la función de ondas de la partícula mediante el producto de la función con el conjugado de sí misma. Todavía debaten los físicos en qué consiste la función de ondas, no saben si es algo físico o sólo una herramienta de cálculo. De entrada, muchas veces sólo se puede representar en el plano complejo (desde el punto de vista matemático tiene parte real e imaginaria) y nunca se puede ver. La probabilidad de encontrar una partícula (un electrón, por ejemplo) se calcula a través de esa función de onda y proporciona un valor para cada punto del espacio considerado. Es decir, hay cierto perfil en esa probabilidad. Cuando todo esto se aplica a los electrones de un átomo se obtienen los orbitales atómicos.
Aneta Stodolna, del Instituto FOM de Holanda, junto a Marc Vrakking del Instituto Max-Born en Berlin y otros colaboradores europeos y norteamericanos han usado la microscopía de fotoionización para obtener imágenes directas de la estructura nodal de los orbitales del electrón del átomo de hidrógeno mientras está inmerso en un campo eléctrico estático. El hidrógeno en este experimento es excitado gracias a pulsos de láser, por lo que el átomo tiene una energía superior a la del estado fundamental, de tal modo que el electrón termina escapando del átomo y llega hasta un detector plano de microcanales que es perpendicular al campo eléctrico (básicamente un detector 2D). Como muchas trayectorias pueden alcanzar el mismo punto del detector se produce un patrón de interferencia que refleja la estructura nodal de la función ondas. Este patrón se puede observar gracias a una lente electrostática que permite más de 20.000 aumentos.
El caso del átomo de hidrógeno es el más sencillo de todos, pues consiste en un electrón y un protón. No hay interacciones con otros electrones del átomo. En este caso hay además un campo eléctrico aplicado, lo que produce una separación de sus niveles de energía (efecto Stark) y que tiene su reflejo en la geometría de la función de ondas (el campo rompe la degeneración).
|
Según los electrones se alejan del átomo y llegan al detector se puede reconstruir la distribución espacial de los patrones nodales en una escala milimétrica que puede ser observada a simple vista sobre el detector y registrada por una cámara. Básicamente lo que se observa es lo que pasa en el átomo. Observando cientos de miles de estos eventos con la misma preparación, como han hecho estos investigadores, se puede reconstruir la estructura orbital.
La figura que aparece inmediatamente antes es precisamente lo que se puede ver, en concreto para átomos de hidrógeno excitados en 0, 1, 2 y 3 veces. Al lado está su distribución radial.
Este equipo de investigadores está ahora usando la misma técnica para átomos de helio y además planean el uso de campos magnéticos sobre átomos de hidrógeno.
Copyleft: atribuir con enlace a http://neofronteras.com/?p=4115
Fuentes y referencias:
Nota de prensa.
Artículo original.
6 Comentarios
RSS feed for comments on this post.
Lo sentimos, esta noticia está ya cerrada a comentarios.




lunes 27 mayo, 2013 @ 8:03 pm
Esto es increíble. Visualizar los órbitales del átomo de hidrógeno, incluso parece contrario a la propia MC, por su esencia probabilistica y matemática por tanto.Quizá despues de todo la funcione de ondas sean algo físico más que una mera herramiento de cálculo de probalidades.
martes 28 mayo, 2013 @ 5:40 pm
No parece contrario a la MC, puesto que se está determinando la posición promedio de los electrones alrededor del átomo. Por lo poco que entiendo de MC, lo que no es posible es determinar a la vez la posición y la cantidad de movimiento de los electrones.. pero en principio no habría ninguna limitación en determinar la posición o la cantidad de movimiento en un momento dado con cualquier grado de precisión
miércoles 29 mayo, 2013 @ 3:48 pm
Estimado pablo:
Se puede hacer ese tipo de mediciones con un alto grado de precisión, pero no con precisión absoluta. En este sentido, me parece muy a tener en cuenta la visión de Mario Bunge en su crítica a la formulación de la MC de lo que él llama la «doctrina» de la Escuela de Copenhage: según Bunge la aplicación de la MC a sistemas complejos requiere desarrollar modelos de dichos sitemas complejos cuya validez es limitada.
De lo anterior se derivarían dos aspectos:
1- Los resultados teóricos pueden ser bastante diferentes de los experimentales.
2- Sólo podemos hacer una confrontación general del conjunto de autovalores y no autovalor por autovalor como afirman los teóricos de la Escuela de Copenhage.
Un cordial saludo.
miércoles 29 mayo, 2013 @ 4:33 pm
Muy buena noticia y muy bien explicada para los que sólo tenemos nociones básicas.
miércoles 29 mayo, 2013 @ 6:40 pm
¿ Y qué tiene que ver determinar la posición o el momento con una gran precisión (no ambas cosas a la vez porque lo impide el principio de incertidumbre) con visualizar los orbitales?. Ya se sabe que la mayor probabilidad de localizar un electrón (o la distribución de densidad electrónica) en el espacio esta descrita por el cuadrado de la función de onda asociada con el orbital correspondiente. Pero otra cosa es visualizar los orbitales, como se ha hecho ahora.
sábado 1 junio, 2013 @ 10:46 am
Siempre había imaginado los orbitales -y parece que es así- como si, en un símil al camino de una persona de su casa al trabajo, se le sacasen miles de fotografías que luego se superpusieran. Habría zonas más densas, por donde pasase más veces, por ejemplo los portales de su casa y de su oficina y algún paso de semáforo y otras menos, por donde sólo transitase de cuando en cuando.
El artículo es muy ilustrativo.