Evolución priónica
Los priones seguirían las mismas reglas darwinistas de evolución que otros entes biológicos, aunque carezcan de material genético al uso.
|
|
|
Un grupo de científicos ha demostrado que los priones tienen la capacidad de adaptase bajo la presión ambiental para así sobrevivir y por consiguiente pueden evolucionar bajo las leyes darwinianas al igual que otros entes biológicos.
La vida es, sobre todo, información organizada. Generalmente esta información está contenida en el ADN o ARN de los organismos. Sin embargo, muchas veces no se considera a los virus como sistemas vivos, pues no son capaces de reproducirse por sí mismos, necesitan células a las que infectar para así reproducirse. Pero aún así mutan y evolucionan para perpetuarse. La gripe de cada invierno así nos lo recuerda. Ser tan simples, les permite a veces evolucionar a mayor velocidad de lo que nuestros sistema inmunitario puede alcanzar de tal modo que siempre estamos infectados.
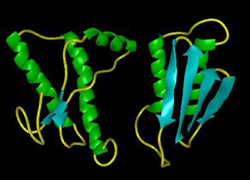
Un prión está un escalón por debajo de los virus y ni siquiera tiene ADN. Son simples proteínas mal plegadas, pero pueden causar enfermedades horribles como las encefalopatías espongiformes que termina agujereando el cerebro de los individuos a los que infectada hasta que esas personas pierden todas las facultades mentales y mueren poco a poco totalmente demendes. Los priones se clasifican en distintas variedades o cepas, caracterizadas por su tiempo de incubación y la enfermedad que causan. Pueden producir la encefalopatía espongiforme, el scrapie en las ovejas o la enfermedad de Creutzfeldt-Jakob en humanos.
Las proteínas son secuencias de aminoácidos, pero lo que les da su verdadera funcionalidad es su plegamiento en una estructura tridimensional. Son tan complejas que un posible plegamiento en un determinado mínimo de energía no tiene por qué ser el único. Normalmente se pliegan bien y si lo hacen mal pueden pasar desapercibidas o provocar algún problema. Lo que distingue a un prión de una proteína mal plegada cualquiera es su capacidad de contagiar su mal plegamiento a las que tienen al lado. Lo sorprendente es que los priones no se reproducen a la manera convencional, creando nuevas moléculas orgánicas, sino que convierten a las proteínas sanas en priones, simplemente les transfieren sólo información «casi inmaterial» y las hacen pertenecer a su “clase”. Lo que se reproduce es la forma de plegarse no las proteínas mismas. Este sistema es tan efectivo que una reacción en cadena (o efecto dominó) de este tipo puede reconvertir grandes cantidades de proteínas celulares en proteínas priónicas. En el caso de las encefalopatías espongiformes la diana son proteínas de las neuronas. La forma mal plegada es tóxica para la célula porque forma grandes agregados de forma laminar que causa daños celulares y finalmente en los tejidos.
Dependiendo del plegamiento se tiene una variedad distinta de prion, aunque la secuencia de aminoácidos puede ser la misma. Siempre y cuando el prión ataque el mismo objetivo se retiene su particular plegamiento. Sin embargo, según los priones se “reproducen” pueden no plegarse en su forma habitual priónica, sino que pueden hacerlo de otras maneras distintas. Digamos que el prión puede “mutar”.
La conducta de los priones hace que se parezcan en su comportamiento infeccioso a los virus, ya que incluso producen estas mutaciones estructurales autopertuantes que les proporcionan ventajas adaptativas. Pero aunque se comporten como virus no son virus. Incluso se puede llegar a poner en duda que los priones evolucionen verdaderamente.
En un estudio reciente unos investigadores dicen haber expuesto cómo los priones evolucionan, adaptándose a un nuevo ambiente. En concreto han encontrado que una particular versión de prion, al ser transferida de una célula nerviosa a una célula de una línea diferente, termina produciendo una variedad nueva que se adapta mejor al nuevo ambiente. Si se transfiere este nuevo prión a una tercera línea celular se adaptan de nuevo. Si al final son de otra vez trasferidos a las células nerviosas originales los priones evolucionarán gradualmente hasta obtener sus antiguas propiedades. Estos investigadores encontraron pruebas físicas de que, al menos en un caso, el plegamiento del prión cambió cuando sus propiedades cambiaron.
En estudios previos se mostró que los priones pueden desarrollar un gran número de mutaciones y estas mutaciones pueden deberse a adaptaciones evolutivas como resistencia a fármacos, un fenómeno que previamente sólo se conocía en bacteria y virus. Además se sugería que las proteínas normales no priónicas podían ser una blanco terapéutico mejor que las proteínas priónicas mal plegada. Como se ha visto que los priones se adaptan a los cambios ambientales, entonces se cree ahora que será difícil diseñar fármacos que los combatan. Pero si se desarrolla uno que inhiba la transformación de una proteína normal en prión se podría impedir el avance de la enfermedad por falta de blancos. Además, este sistema no iría en detrimento de la salud del sujeto, tal y como se mostró ya en ratones.
En el nuevo estudio se encontró que cuando una población de priones es transferida a un anfitrión diferente una de las variedades puede replicarse más rápido, algo que constituye una ventaja adaptativa, y puede terminar siendo la cepa dominante. Esta nueva población puede a su vez contener otras variantes que pueden ser seleccionadas al ser transferidas a un nuevo anfitrión.
Por tanto, aunque los priones no tienen material genético al uso, se comportan como los virus y otras agentes infecciosos, pueden mutar y sufrir selección natural. En este caso evolucionan cambiando su plegamiento en lugar de cambiar su secuencia genética.
El nuevo estudio sugiere además que las poblaciones de priones constituyen cuasi-especies similares en su naturaleza a los retrovirus aunque sean muy diferentes a ellos. Al final ambos tienden a cambiar su estructura para sobrevivir, aunque esto lo hagan de manera muy diferente.
Copyleft: atribuir con enlace a http://neofronteras.com/?p=3337
Fuentes y referencias:
Nota de prensa.
Artículo original.
18 Comentarios
RSS feed for comments on this post.
Lo sentimos, esta noticia está ya cerrada a comentarios.




lunes 20 diciembre, 2010 @ 1:24 pm
Parece ser que basta con la autoreplicación, portar la información necesaria para ello y que esta pueda variar para que la evolución empiece a funcionar. Incluso se ha sugerido que las ideas evolucionan de manera similar aunque solo son patrones de información…
lunes 20 diciembre, 2010 @ 1:57 pm
Me temo que no entiendo cómo una proteína convence a otras de que se plieguen mal. Lo de la «información inmaterial» me descoloca. Tendrá que haber algún mediador entre el prión y las proteinas a contagiar, ¿no?.
Saludos
lunes 20 diciembre, 2010 @ 2:20 pm
De acuerdo con JOrge: la replicación de información es la clave de la evolución: si la información genera un ser vivo «tradicional», un virus, un prión, incluso un cristal «inanimado» o algo inmaterial como una idea o meme.
lunes 20 diciembre, 2010 @ 2:31 pm
De acuerdo con JOrge: la replicación de información es la clave de la evolución: si la información genera un ser vivo «tradicional», un virus, un prión, incluso un cristal «inanimado» o algo inmaterial como una idea o meme, parece ser algo secundario.
lunes 20 diciembre, 2010 @ 3:01 pm
Estimado joabbl
No parece haber un mediador, simplemente la proteína mal plegada se junta con otras bien plegadas y hace que éstas se plieguen mal.
En cuanto a la información inmaterial, es verdad que estrictamente no es así. Se trata de expresar que la información en este caso reside en la forma y no en la secuencia de aminoácidos. Se ha añadido un entrecomillado para así mejorar el texto.
lunes 20 diciembre, 2010 @ 3:37 pm
En cualquier caso parece algo misterioso. Precisamente hay un proyecto de investigación casero on-line (de Boinc) sobre plegamiento de proteínas. Parece un tema muy complejo. Además, los priones podrían ser también un arma biológica, como los virus. Probablemente también se acabe encontrándoles alguna utilidad médica.
Saludos
lunes 20 diciembre, 2010 @ 7:12 pm
Pues estoy con joabbl en que la cosa queda un tanto misteriosa.
Sin embargo, a vuelapluma y sin consultar Google ni nada, me atrevo a proponer que lo que quizá ocurra sea un cambio inducido por el prión en el medio ambiente de las demás proteínas, y que lleva a un incorrecto plegado de las mismas. Muchos de los 20 aminoácidos que conforman las proteínas tienen grupos cargados eléctricamente. Al plegarse, esas cargas quedan más o menos expuestas al exterior. Y, a su vez, la forma concreta de un plegamiento proteínico depende de la distribución de cargas en su ambiente. Un cambio aleatorio en el plegamiento del prión originario cambiará su actividad eléctrica, y quizá pueda alterar lo suficiente su medio ambiente inmediato como para influir en el normal plegamiento de otras proteínas que estén muy próximas.
Es una hipótesis muy aventurada, pero de todas formas quizá no esté mal recordar que las proteínas son unas moléculas bastante dinámicas, y su estructura y función se ven muy influidas por el medio que las rodea.
Saludos.
martes 21 diciembre, 2010 @ 3:27 am
Por que a nadie se le ha ocurrido poner a programas informáticos a competir entre si con la premisa de que pueden reproducirse mas en tanto mejoren su capacidad cognitiva??
martes 21 diciembre, 2010 @ 7:46 am
La hipótesis de Ramonmo es interesante. Imagino que tiene que ser algo así. Una especie de reacción química por proximidad de algunas partes de la proteína, un intercambio o realineamiento de cargas eléctricas. Puestos a imaginar se me ocurre que los priones podrían tener una utilidad médica. Si un gen codifica una proteína y dicho gen ha mutado de manera que hace mal su trabajo tal vez se podría diseñar un prión para «corregir» dichas proteínas erróneas. Entiendo que esto actualmente es ciencia-ficción, pero quien sabe si algún día…
En cuanto al comentario de JOrge creo que existen experimentos de ese tipo, pero entiendo que ningún programa informático tiene hasta la fecha «capacidad cognitiva», la definamos como la definamos, y nadie parece capaz de generarla artificialmente. Se ha escrito mucho sobre ese tema, como el famoso La Nueva Mente del Emperador de Roger Penrose, que argumenta que un ordenador digital nunca podrá tener inteligencia. Entiendo que es un tema abierto.
Saludos
martes 21 diciembre, 2010 @ 8:34 am
Me sumo a la tesis de Ramonmo. Es más, yo quería proponer algo así, es decir basándome en hidrógenos que quedasen dispuestos a unirse o a obligar la modificación de la forma de una proteína próxima por simple atracción eléctrica pero claro, eso no conlleva necesariamente a una copia igual; sin duda ha de haber algo más que se nos escapa. Ciertamente la palabra misterio es muy apropiada en este caso.
¿Nos quedaremos como «El pensador» de Rodin, convertidos en sus macropriones?
martes 21 diciembre, 2010 @ 9:38 am
El plegado de proteínas es uno de los problemas más difíciles de la ciencia. De momento no podemos saber, a partir de la secuencias de aminoácidos, cómo se plegará una proteína para adquirir esa estructura terciaria.
La estructura terciaria muchas veces no se puede saber a partir de muestras de las proteínas mismas. Otras veces sí, gracias a algún proceso de cristalización (algunas veces específico para la proteínas en cuestión) o a técnicas de resonancia magnética nuclear.
Se sabe que el potencial de energía de una proteína puede ser complejo, con varios o muchos mínimos de energía. La proteína «cae» en un mínimo de energía y adopta su forma final. Se cree que en la mayoría de los casos ese mínimo es el mínimo absoluto. Un caso similar se da en vidrios de spin, redes sociales de amistad y otros sistemas complejos.
En este caso de los priones, da la impresión de que hay al menos dos mínimos y que se puede pasar del «bueno» al «malo» previa «catalización» por la presencia del prion. Digamos que el prión permite un «efecto túnel» de un mínimo a otro.
Según se desprende de estos artículos hay más de dos mínimos (mutaciones) dependiendo del ambiente. Y es que las proteínas en sí no tienen mucho sentido si no se considera su contexto.
martes 21 diciembre, 2010 @ 8:21 pm
Eso es definitivo: «La vida es, sobre todo, información organizada». Incluso para la replicación que es la base de la evolución se precisa una información organizada.Las copias replicadas son información replicada.Incluso para descodificar los secretos del universo me parece que va a ser más valida la teoria de la información que las teorias de partículas materiales conocidas.Las simulaciones matemáticas en computadoras, la biología sintética computacional, la vida artificial..todo eso forma parte de información organizada.Ahí está por ejemplo el famoso «juego de la vida»(en un universo 2D) del matemático Conway…eso es información que origina formas de vida.
«¿efecto túnel?», «¿estados de mínima energía?.¿No está en el fondo de la cuestión la MC?.
miércoles 22 diciembre, 2010 @ 6:23 am
Me has convencido, amigo lluís. Estoy absolutamente de acuerdo contigo. Y me parece que esta posición que, gracias a ti, ahora adopto, no va en contra de mis previas convicciones. ¿Cuando tendré tiempo de atacar a la MC y no quedarme en su superficie más elemental? No sabes cómo te admiro.
Un abrazo.
miércoles 22 diciembre, 2010 @ 7:36 pm
Muchas gracias, tomás; pero no creas, yo no sé mucha MC, me defiendo un poquitin solamente.De todos modos si tienes un poco de tiempo y te adentras en la MC creo sinceramente que te lo pasarás bien (siempre y cuando disfrutes con las matemáticas).
Una abrazo,tomás.
miércoles 22 diciembre, 2010 @ 7:45 pm
¡Muy buenos los comentarios finales de Neo, lluis y tomás!…en el modelo «ORCH» Penrose y Stuart Hameroff intentaron crear un modelo del funcionamiento del cerebro humano a nivel cuántico postulando la existencia de «agua vincinal» en los microtúbulos de las neuronas.
Es una teoría incompleta, pero enlaza con lo que estamos hablando: sería interesante tratar de computar a nivel cuántico estas transiciones entre diferentes «estados de energía» de una proteína.
Saludos.
miércoles 22 diciembre, 2010 @ 11:58 pm
¡Perdón! quise decir «agua vicinal».
…según la teoría de Penrose nuestro cerebro es un supercomputador con una capacidad de amplificar la respuesta del orden de 10 elevado a 13 (mayor que cualquier superordenador actual) o incluso 10 elevado a 14 (en la página de Hameroff se habla de cifras mayores!!!)
…y de repente llega una minúscula glucoproteina priónica sin genes ni DNA ni mitocondrias ni nada de nada y desafina tan magnífica orquesta.
Maravilloso y sorprendente Universo o Multiverso…
jueves 23 diciembre, 2010 @ 8:43 am
Muy estimado lluís: Las matemáticas me encantan pero tiempo no tengo nada. Podrás decir: ¿y por qué escribes tanto aquí?. Y te contesto: Por puro vicio. Quizá porque apenas puedo hablar con nadie cuya conversación me llene. La página y vosotros hacen que sea lo primero que hago al levantarme, lo que hago a las cinco y media. A las 21:30 h abandono. Entre tanto, principalmente escribo sobre lo que creo es un deber, aparte de mis obligaciones familiares que no son pocas.
En fin, ya ves. Un gran abrazo.
jueves 23 diciembre, 2010 @ 5:06 pm
Estimado Miguel Angel:
Desde hace ya muchos años se trata de simular el plegamiento de proteínas. Desgraciadamente es un problema computacionalmente complicado. Lo que ocurre es que el sistema simulado puede caer en un mínimo local y quedarse ahí atascado durante mucho tiempo.