En busca de la segunda isla de estabilidad
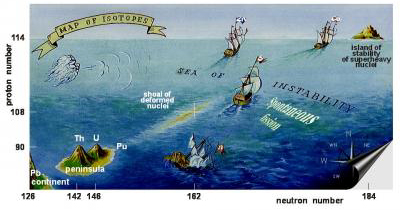
Los modernos científicos nucleares han descubierto recientemente una isla de estabilidad en los mares de la tabla periódica donde habitan elementos superpesados. Ya especulan sobre una segunda.
|
En el congreso número 235 de la American Chemical Society uno de estos científicos asistentes ha descrito cómo los investigadores están buscando esa nueva isla a mayor distancia.
Según Yuri Oganessian, del instituto de investigación nuclear de Dubna (Rusia), ahora que se ha demostrado la existencia de la isla de estabilidad de elementos superpesados sería interesante comprobar la posición de otras islas predichas teóricamente.
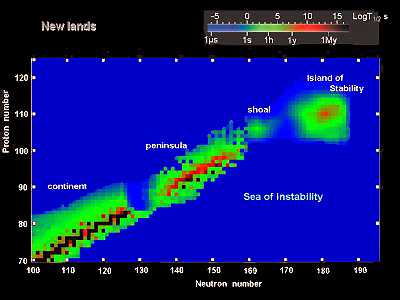
El descubrimiento de elementos superpesados a principios de este siglo por parte del grupo de este investigador confirmó la existencia de la isla de estabilidad, una región de la tabla periódica con elementos estables de alto número atómico. La metáfora de la isla surge porque los elementos colindantes son tan inestables y de vidas tan cortas que se puede decir que tales elementos (o sus isótopos) no existen, mientras que los elementos superpesados de la isla son mucho más estables (aunque terminan por desintegrarse al poco tiempo de ser creados de todos modos).
El grupo de Oganessian y el Lawrence Livermore Laboratory (California) consiguieron sintetizar (¿descubrir?) en los pasados seis años los elementos 113, 114, 115, 116 y 118. Estos elementos no existen en la Naturaleza y sólo se pueden obtener mediante colisionadores de iones pesados.
La tabla periódica de los elementos es un listado ordenado que, atendiendo a diversos criterios, distribuye los distintos elementos químicos conforme a ciertas características. Estos elementos se combinan químicamente entre sí para formar las sustancias que forman todo el Universo o el cuerpo humano.
Los elementos más ligeros como el hidrógeno, helio o litio surgieron en el Big Bang, mientras que los elementos un poco más pesados se sintetizan en el interior de las estrellas gracias a reacciones nuclear de fusión. Los más pesados que el hierro se originan en las propias explosiones de supernovas. Los elementos inestables que se pudieran sintetizar en este último proceso terminan por desintegrarse, por eso no se encuentran elementos más pesados que el uranio (elemento número 92) en la Naturaleza. El resto se tienen que sintetizar en los laboratorios de Física Nuclear. En estos lugares se aceleran átomos ionizados y se los hace chocar contra otros a un décimo de la velocidad de la luz para forzar su fusión.
Las características químicas de los elementos dependen de los electrones. Éstos «órbitan» alrededor del núcleo por «capas» que se van llenando. Que la última capa esté más o menos llena produce las características químicas particulares del elemento. Por eso los elementos se distribuyen por grupos (columnas) en la tabla periódica, porque los elementos de una misma columna tienen propiedades similares al tener sus últimas capas rellenas de electrones de forma similar. Como el número de electrones depende del número de protones del núcleo, que es igual al número atómico, según aumenta éste se van llenando las distintas filas (periodos) de la tabla periódica de manera cíclica.
|
|
|
En la isla de estabilidad ha surgido la polémica. El elemento 114, que según su posición en la tabla periódica debería de comportarse químicamente como el plomo, según el grupo de Dubna parece que se comporta más bien como un gas noble. Achacan este supuesto comportamiento a un efecto relativista de los electrones más externos de los átomos de este elemento, que se moverían a una velocidad en la que los efectos relativistas se deberían de notar más.
Los efectos relativistas se observan en otros elementos que no son necesariamente exóticos, y no plantean problemas. Pero, según los teóricos, efectos tan dramáticos como los supuestamente observados en el elemento 114 sólo se darían en elementos muy muy pesados, del orden del 160 ó 170 de número atómico.
Quizás estos problemas son una consecuencia de que este elemento decaiga al cabo de unos segundos y no se puedan medir bien sus características químicas. Este elemento es producido fusionando núcleos de calcio y plutonio. El átomo resultante consigue su neutralidad eléctrica tomando electrones de la atmósfera de argón ultrafrío que es preparada dentro de un tubo recubierto interiormente de oro. Para medir sus características químicas lo más rápidamente posible los investigadores colocan este tubo en la zona de síntesis. Los átomos metálicos similares químicamente al plomo tenderían a fijarse a esa superficie de oro, recorriendo poca distancia desde su síntesis, pero un gas noble recorrería más distancia al no interaccionar químicamente con nada, y menos con el oro. Ésto es precisamente lo que observan estos investigadores para el elemento 114.
El grupo de Oganessian está ahora intentando sintetizar el elemento 120 y otros en la isla de estabilidad. Este investigador cree que a mayor distancia debe de haber otra u otras islas de estabilidad que deberían de ser exploradas en un futuro.
Cree que esta nueva isla, según las predicciones de los cálculos teóricos, debe de estar muy lejos de la primera, alrededor del número atómico 164. Es difícil llegar a esta isla y los físicos necesitarán aumentar la intensidad del haz de iones y probablemente construir nuevos aceleradores para esta meta.
Sobre las posibles aplicaciones de este tipo de investigaciones se podría citar como ejemplo el americio, elemento número 95 que fue descubierto en 1944, que se usa en detectores de humo y en medicina, así como en algunos procesos industriales. Aunque para los elementos superpesados cuesta imaginar aplicaciones, sobre todo por la poca cantidad que se puede sintetizar y lo rápido que desaparece.
Estos investigadores se mueven en el mar de isótopos a bordo de potentes maquinas, guiándose por cartas marinas (en parte teóricas) cuyas latitud y longitud son el número de protones y neutrones. Esperan llegar a una nueva isla sin que el «escorbuto» o el hambre les alcance. En cuanto a lo que haya en esas otras islas de estabilidad sólo lo sabremos cuando lleguen allí. Quizás les espere un El Dorado sólo para físicos, lleno de los elementos de comportamiento extraño.
Fuentes y referencias:
Nota en Eureka Alert.
Tabla periódica elemental (humor).
5 Comentarios
RSS feed for comments on this post.
Lo sentimos, esta noticia está ya cerrada a comentarios.




miércoles 16 abril, 2008 @ 4:22 am
Excelente nota. Me pregunto si es totalmente imposible que se encuentren con una isla de elementos no radiactivos. Tendría aplicaciones enormes en la ciencia ficción.
miércoles 16 abril, 2008 @ 5:53 pm
Es interesante haber conseguido demostrar la existencia de esta isla de estabilidad. Me interesaría saber si esto podría sugerir la introducción de un nuevo tipo de orbital atómico y que tan riesgoso podría resultar intentar conseguir elementos superpesados.
jueves 17 abril, 2008 @ 12:46 am
Los elementos superpesados que estén más allá de la isla de estabilidad probablemente tengan vidas medias muy cortas. Si no fuera así estarían presentes de forma natural en la naturaleza.
Así que todos serán radiactivos y con poca o ninguna aplicación práctica.
La mecánica cuántica explicaría en todo caso el comportamiento de estos elementos, tanto a nivel nuclear como de orbitales.
sábado 19 abril, 2008 @ 11:27 am
Viendo el grafico que adjuntais parece que en esa isla de estabilidad se predicen elementos bastante estables (entre 1 año y un millón de años de vida media).
Las supernovas, los rayos cósmicos o las proyecciones de los pulsar deben generar energías suficientes como para producir estos elementos. Y medio millón de años de vida media seria suficiente para que estos elementos existan en cantidades apreciables en las zonas donde se generan (no en la tierra). La espectrografía debería detectarlos en los restos de supernovas.
sábado 19 abril, 2008 @ 12:00 pm
Como la Tierra se formó hace unos 5000 millones de años esos elementos habrán desaparecido, sobre todo si tenemos en cuenta la poca cantidad de ellos que habría.
Sin embargo, esa idea que sugiere del espectro de supernovas parece bastante interesante.