Descubren priones en bacterias
La aparición de los priones en la Tierra se tuvo que dar hace más de 2300 millones de años, que es cuando aparecieron los eucariotas.
|
Lo malo de morirse no es sólo que dejas de vivir o que vives un periodo de tiempo relativamente corto. Lo peor de morirse es que te pierdas todo lo que pasa después.
Ahora que se estilan las series de TV ambientadas en los ochenta, podemos recordar que en esos tiempos no se había descubierto la energía oscura, no teníamos ni idea de cómo era Plutón, no se había descubierto el bosón de Higgs ni las ondas gravitacionales y los priones eran algo inconcebible, aunque se propuso su existencia precisamente en ese época.
La sola idea de un sistema orgánico infeccioso capaz de reproducirse sin tener ADN ni ARN suena a sacrilegio, pero los priones son exactamente eso.
Los priones se clasifican en distintas variedades o cepas, caracterizadas por su tiempo de incubación y la enfermedad que causan, pero no son más que proteínas mal plegadas.
Las proteínas son secuencias de aminoácidos, pero lo que les da su verdadera funcionalidad es su plegamiento en una estructura tridimensional. Muchas veces son tan complejas que un posible plegamiento en un determinado mínimo de energía no tiene por qué ser el único.
Normalmente las proteínas se pliegan bien y si lo hacen mal pueden pasar desapercibidas o provocar algún problema. Lo que distingue a un prion de una proteína mal plegada cualquiera es su capacidad de contagiar su mal plegamiento a las que tienen al lado.
Lo sorprendente es que los priones no se reproducen a la manera convencional, creando nuevas moléculas orgánicas, sino que convierten a las proteínas sanas ya existentes en priones, simplemente les transfieren una información “casi inmaterial” por contacto y las hacen pertenecer a su “clase”.
Lo que se reproduce es la forma de plegarse, no la proteína misma. Este sistema es tan efectivo que una reacción en cadena (o efecto dominó) de este tipo puede reconvertir grandes cantidades de proteínas celulares en proteínas priónicas. En el caso de las encefalopatías espongiformes, la diana son proteínas de las neuronas. La forma mal plegada es tóxica para la célula porque genera agregados de forma laminar que causan daños celulares y finalmente también en los tejidos.
Desde que se descubrieron los priones, además de saber que provocan enfermedades en humanos, se han hallado formas infeccionas en varios eucariotas, que incluye a los animales (mamíferos, insectos y gusanos), algunas plantas y algunos hongos.
Pero en este tiempo también se ha podido ver que los priones juegan un papel en la formación de la memoria, que evolucionan, que pueden ayudar a la célula, que pueden pasar de una especie a otra o que controlan la epigenética de levaduras.
Ahora se publica un nuevo resultado que sostiene que hay priones también en las bacterias, por lo que los priones también estarían presentes en los procariotas además de en los eucariotas.
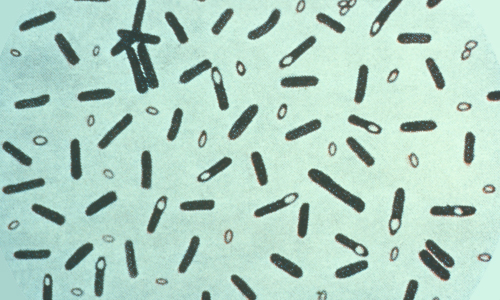
Al menos una sección de una proteína de la bacteria Clostridium botulinum (la bacteria que provoca el botulismo, en la imagen de cabecera) se comporta como un prion cuando se inyecta en levaduras o bacterias E. Coli.
En este estudio se analizaron unos 60.000 genomas bacterianos para buscar secuencias genéticas que fueran similares a aquellas que forman priones en las levaduras. Encontraron que una sección o dominio de la proteína Rho que se da en muchas bacterias era una buena candidata. Esta proteína juega un papel como reguladora global en la expresión y actividad de muchos genes.
Cuando inyectaron esta proteína en E. coli comprobaron que se formaron agregados de proteínas mal formadas. Y cuando la inyectaron en levaduras reemplazó la función de un conocido prion de la levadura.
Además, comprobaron que la versión normal de la proteína Rho suprimía la actividad genética en E. coli y muchos genes eran activados cuando la proteína estaba en su forma priónica.
Según Ann Hochschild (Harvard Medical School), esto sugiere que los priones pueden ayudar a las bacterias a adaptarse a ciertos cambios ambientales, mediante la regulación de los genes. Así, por ejemplo, las bacterias E. coli con la versión priónica de Rho era mejor a la hora adaptarse a la exposición al etanol que con la versión no priónica de esa proteína.
Como los priones son heredables, es concebible pensar que estas proteínas pudieran permitir que las bacterias hereden rasgos sin necesidad de mutaciones genéticas. Esto les permitiría una respuesta rápida a cambios ambientales, como pueda ser la presencia de un antibiótico, lo que tendría implicaciones prácticas en Medicina.
Desde el punto de vista de ciencia básica, el hallazgo nos dice que los priones están mucho más extendidos en la Naturaleza de lo que habíamos pensado, que pueden llegar a jugar un papel en la evolución y que la relación priónica precedió a la aparición de los eucariotas y que, por tanto, los priones aparecieron hace más de 2300 millones de años.
Copyleft: atribuir con enlace a http://neofronteras.com/?p=5259
Fuentes y referencias:
Artículo original
Priones en NeoFronteras.
Foto: Centers for Disease Control and Prevention’s Public Health Image Library (PHIL), vía Wikipedia.
10 Comentarios
RSS feed for comments on this post.
Lo sentimos, esta noticia está ya cerrada a comentarios.




domingo 15 enero, 2017 @ 8:55 am
«Lo peor de morirse es que te pierdas todo lo que pasa después.»
Muy cierto con respecto al conocimiento científico.
En otros varios aspectos de nuestra especie no lo veo tan claro.
¡¡Seguimos quitándole tornillos al «aparato» sin ser ingenieros, sin ni tan siquiera haber hecho un cursillo elemental de mecánica!!
domingo 15 enero, 2017 @ 5:37 pm
Buenas!
Interesante entrada pero opino que el titulo es desafortunadamente equívoco. Por lo que se transcribe del texto, Rho de Clostridium botulinum (Cb-Rho) tiene un dominio conservado en las proteínas prionicas de levaduras y que le permite canviar a conformación prionica (en E.coli).
En esta entrada se puede sobreentender erróneamente que solo introdujeron el dominio prionico en E. coli, quizá se podria aclarar que era Rho entera (como mínimo eso sobreentiendo del abstract del artículo). Seria interesante observar si el carácter prionico de Rho está conservado en homólogos de otras especies, quizá hay una relación evolutiva y estamos ante una posible pista sobre el pasado evolutivo de los priones (más allá de lo que comenta el artículo que sugiere que predatan la división evolutiva Eucaryota / Procariota) o quizá simplemente es un caso de convergencia evolutiva. En cualquier caso yo no hablaría de «priones en bacterias» dado que la conformación prionica no la consiguieron en C. botulinum, el entorno natural de Cb-Rho. Quizá algo como: «Descubren proteína bacteriana que puede canviar a prion», o por el estilo (mi capacidad divulgativa es muy inferior a Neofronteras). Es menos vistoso pero correcto, tampoco es culpa de la página que el propio artículo tenga el titular sensacionalista (y equívoco), cosas de los journals de alto impacto y sus obsesiones…
domingo 15 enero, 2017 @ 6:55 pm
Elmenda:
Se ha realizado un pequeño cambio para que quede claro que se introduce toda la proteína.
En cuanto al titular es correcto, pues no se especifica en qué bacteria. Tal y como se cuenta, se consigue en E. coli, que es una bacteria, aunque esta proteína provenga de C. botulinum. El título del artículo original es:
A bacterial global regulator forms a prion
No parece que sea sensacionalista. Tampoco hay que sobre-entender que los priones son siempre infecciosos. Sobre la evolución convergente, es algo a lo que habrá que esperar para tener más pruebas y casos sobre todo el asunto.
lunes 16 enero, 2017 @ 8:17 am
Para mí, que tan poco sé de priones, lo que me maravilla es cómo vamos sumando posibles actores a la evolución, pudiendo mantener sus tres patas fundamentales: variabilidad de la descendencia, heredabilidad de la coadaptación, y mayor multiplicación de los más aptos. Algo así viene a decir Gould, aunque creo recordar que para él son ramas en vez de patas.
miércoles 18 enero, 2017 @ 4:16 pm
Como que: » lo que distingue a un prión de una proteína mal plegada cualquiera es su capacidad de contagiar su mal plegamiento a las que tiene al lado-por contacto-«, pues igual ese «contagio» por contacto se debe a que el prion les transmite momento angular a las proteínas que tiene al lado.
miércoles 18 enero, 2017 @ 9:55 pm
Estimado Lluís:
No creo que sea eso. La secuencia de aminoácidos puede ser incluso la misma y sólo diferir en el plegamiento. Una y otra tienen mínimos relativos de energía diferentes. La «mala» posee un mínimo más bajo y la buena más alto. La proteína mala hace las veces de un «efecto túnel» o de catalizador y la proteína buena pasa al otro mínimo más bajo plegándose diferente. Pero el plegamiento da la funcionalidad y puede permitir la formación de agregados malignos que maten la célula. Teóricamente incluso se podría dar con mínimos de igual energía potencial.
jueves 19 enero, 2017 @ 11:26 am
Pues en mi mentalidad, el efecto túnel o el catalizador, me parecen analogías. Sinceramente recurriría a leves fuerzas electromagnéticas que, sí, permitirían pasar del estado de más baja energía de plegado de la proteína normal a la del plegado de menor energía aún mediante una aportación de energía que permita ese salto -bueno, posible efecto túnel-, de manera que la normal adquiriese la menor energía que posee su mala compañera -pues para ello han de estar muy cerca, digo yo-.
Mal plegá
Te llaman la mal plegá
porque mi electrón te di
y ya jamás lo sentí,
mal plegá
fuisté proté.
(Hay que cantarla como «La bien pagá»; el pago es el electrón)
Bueno, una tontería más de las mías; pero me divierte.
Chao.
jueves 19 enero, 2017 @ 4:31 pm
En mi opinión, amigo Tomás, lo que explica Neo en su comentario 6, refiriéndose a un posible «efecto túnel» es algo más que una analogía,me parece una buena idea, ya que ese efecto dice que una partícula siempre tiene una cierta probabilidad de atravesar una barrera de potencial, aunque su energía sea inferior a la de la altura de la barrera. Además el «efecto túnel» se ha podido observar en barreras de potencial de unos pocos nanómetros y también se ha observado en algunos tipos de mutaciones espontáneas en moléculas de ADN.
Ah! y las cosas que divierten no son tonterías, por lo general cumplen una digna función, precisamente divertirse. Cosa que no es tan fácil.
Un saludo, amigo.
viernes 20 enero, 2017 @ 8:19 am
Pues muchas gracias, querido Lluís. Algo rumiaba yo sobre ello en el inciso del primer párrafo de mi 7, pero sin la seguridad que tú me das -seguridad cuántica, naturalmente, o sea: superposición de «sí, no, y todo lo contrario»-. Y, sí, creo recordar haber leído que se da en el ADN.
Y con eso de divertirme, me lo monto solo. A veces recuerdo -o me vienen a la cabeza (no va a ser a los pies)- situaciones chungas y me río lo mio. En tiempos que ya empiezan a ser lejanos, mi exposa, veía que, de pronto, me reía, aparentemente sin motivo. De las pocas veces que me atreví a explicarle la ocurrencia, muy contadas le hicieron gracia alguna, y es que su sentido del humor era y es algo así como el de un camello, que ni se ríe ni nada, le cuentes lo que le cuentes. Tan escasas debieron ser que solo recuerdo una en la que dije viendo la tele juntos: «escucha, que van a cantar los sabandijeños»; no pudo evitar iniciar una carcajada que debió atragantársele, porque se la tragó ipso facto, seguramente para demostrar su seriedad; yo me descosí por su empeño en demostrarse estoica y recibí justa recriminación por mi poca gracia; bueno, más bien por ser tan soso. Así que ya ves. Por suerte, en ese aspecto, diría que diariamente se me ocurre algo de lo que puedo reírme. Fíjate que, habiéndome roto el día anterior varias costillas que casi no me dejaban respirar porque una de ellas fue la que viene por la izquierda de la vértebra D-7 que creo que soporta bastante el diafragma, viendo la película «¡Que te calles!» -Dirige Francis Veber; actores: Gérard Depadieu, Jean Reno-, no podía evitar reírme a pesar el dolor que me causaba. Tenía que autoabrazarme con fuerza Miguelangeliana, es decir, electrofanfarrónica. La recomiendo, pero no comiendo porque se puede uno atragantar. ¿Ves lo cuántico de la cosa?: recomer, pero no comer; ¡asombroso!
Bueno, ya habló el abuelo Cebolleta con sus batallitas.
Chao.
domingo 5 febrero, 2017 @ 9:54 pm
Y mi propuesta es…¿No se podría utilizar esto como la fuente de una nueva generación de «antibióticos»? :-)