¿Elementos de la isla de estabilidad en una estrella?
Proponen que una estrella podría tener elementos pertenecientes a la hipotética isla de estabilidad.
|
El Universo no tiene un plan un objetivo o una meta. No está determinado por su final, sino por su comienzo: el Big Bang.
Todo lo que nos rodea es una consecuencia última de lo que pasó durante el Big Bang. Ese estado de baja entropía que es lo que parece que ha permitido la evolución hacia la complejidad del Cosmos.
Al poco de darse en Big Bang se puso en marcha la maquinaria nuclear y empezaron a formase elementos más pesados que el hidrógeno, principalmente helio. Esta producción de elementos se detuvo cuando la expansión del Universo diluyó y enfrío la materia que contenía. A partir de ahí las reacciones de fusión sólo se dieron en las estrellas.
Somos cenizas de estrellas. El carbono o el nitrógeno de las proteínas de nuestros cuerpos se sintetizaron en algún momento en el horno nuclear de alguna antigua estrella. Los elementos más abundantes del Universo son también los elementos de los que está hecha la vida, salvo el helio, que al ser noble, no es usado por la vida. Al fin y al cabo, la vida no es más que química auto-organizada.
En el interior de las estrellas sólo se llega a sintetizar hasta el hierro, los elementos de número atómico superior no son producidos allí. Esos elementos se producen en las explosiones de supernovas y en la colisión de estrellas de neutrones.
Algunos de esos elementos tienen vidas cortas y se desintegran al cabo de un tiempo. Pero las leyes de la física son generosas y nos proporcionan métodos para sintetizar elementos con alto número atómico. Algunos transuránidos se pueden sintetizar por captura de neutrones en un reactor nuclear. Otros, los más pesados, como los elementos transactínidos, sólo si se hacen chocar iones contra blancos de elementos pesados específicos.
Algunos de los elementos transactínidos han sido nombrados recientemente. Esta es la lista de los elementos con número atómico más alto encontrados hasta el momento: rutherfordio (Rf 104), 105 dubnio (Db 105), seaborgio (Sg, 106), bohrio (Bh 107), hassio (Hs 108), meitnerio (Mt 109), darmstadtio (Ds 110), roentgenio (Rg 111), copernicio (Cn 112), nihonio (Nh 113), flerovio (Fl 114), moscovio (Mc 115), livermorio (Lv 116), teneso (Ts 117) y oganesón (Og 118).
Estos elementos son todos radiactivos y con vidas medias muy cortas, aunque esta depende mucho del isótopo del que se trate. Para hacernos una idea, se cree que el isótopo 114Fl289 tiene una vida media de 66 segundos y sería de los más longevos. El 108Hs269 tiene un periodo de semidesintegración de 9,7 segundos. Mientras que el isótopo 112Cn285 tiene una vida media de sólo 0,24 ms. La vida media del moscovio es de 100 ms y el isótopo 118Og293 tiene un periodo de semidesintegración de menos de un milisegundo, pero aun así se considera que su núcleo es ligeramente más estable de lo predicho por situarse cerca de la isla de estabilidad. Este último elemento fue sintetizado con iones de calcio impactando sobre un blanco de californio.
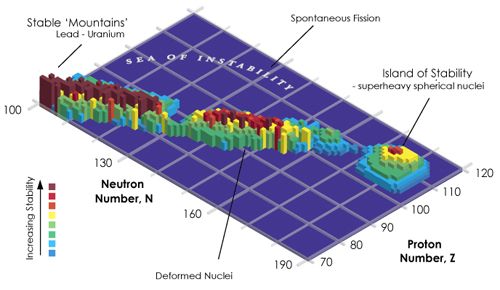
La isla de estabilidad es una propuesta teórica según la cual ciertos isótopos de algunos elementos superpesados podrían tener vidas mucho más largas de lo esperado (ver imagen de cabecera). Aunque este es un tema en el que los expertos no ponen de acuerdo a falta de pruebas experimentales que lo confirmen.
Ahora, un trío de astrofísicos sugiere que se deberían buscar estos elementos “estables” con número atómico 114 o mayor en ciertas estrellas. Según Vladimir Dzuba (University of New South Wales) y sus colaboradores, la estrella de Przybylski o HD 101065 podría tener este tipo de elementos.
Esta estrella fue descubierta por Antoni Przybylski en 1961 y se encuentra a 370 años luz de nosotros en la región del cielo que denominamos constelación de Centauro. Es una estrella rara por contener poco hierro y níquel, pero mucha cantidad de elementos pesados.
Esta estrella es la única conocida que parece contener cantidades apreciables de elementos actínidos cuyos números atómicos van de 89 a 103, como el plutonio, americio o el einstenio. Sólo la estrella HD 25354 se le acerca en este aspecto al tener un poco de americio y curio, pero en menor cantidad. Sin embargo, la presencia de estos elementos está todavía por confirmar.
Pero explicar la presencia de estos elementos en esta estrella ya es de por sí complicado. Una hipótesis es que HD 101065 tuviera una estrella de neutrones por compañera que bombardeara su superficie con elementos con partículas y que así se generasen estos elementos pesados. Lo malo es que todavía no se ha encontrado a tal estrella de neutrones, si es que existe.
Según Dzuba la presencia de estos actínidos podría ser la pista sobre la predicha isla de estabilidad y estos elementos serían precisamente los subproductos del lento decaimiento de otros más pesados. Básicamente, los actínidos tienen vidas cortas y se desintegrarían en su totalidad al cabo de un tiempo. Como la estrella tiene, como mínimo, millones de años, entonces debe de haber un mecanismo que los reemplace y este sería la desintegración de elementos aún más pesados de la isla de estabilidad con vidas muy largas. Los elementos de la isla de estabilidad habrían sido generados por algún mecanismo en el pasado y serían los únicos supervivientes de una gran producción de elementos pesados por tener vidas medias muy largas.
Pero para poder demostrar esta afirmación habría que encontrar en el espectro de esta estrella las líneas del nobelio, lawrencio, nihonio y flerovio, que serían los pasos intermedios de decaimiento radiactivo desde la isla de estabilidad. Lo malo es que estas líneas no se conocen experimentalmente porque, aunque se ha logrado sintetizar estos elementos, sus periodos de semidesintegración son muy cortos y su cantidad tan escasa que no permiten tomar un espectro.
Para rematar, la atmósfera de esta estrella es altamente magnética, estratificada y químicamente complicada, así que la interpretación de los espectros es muy difícil. Incluso podría ser que la supuesta presencia de actínidos no fuera más que un espejismo producido por estas características.
Otro problema sería explicar cómo, en primer lugar, se sintetizaron esos elementos de la isla de estabilidad.
Copyleft: atribuir con enlace a http://neofronteras.com/?p=5422
Fuentes y referencias:
Artículo original.
Gráfico: Wikipedia.
8 Comentarios
RSS feed for comments on this post.
Lo sentimos, esta noticia está ya cerrada a comentarios.




domingo 26 marzo, 2017 @ 5:27 pm
Pero si los átomos poseen espectros característicos, y también los moléculas o los núcleos,¿Cómo se sabe que todos esos nuevos elementos,por ejemplo, el nobelio, el lawrencio, el nihonio y el flerovio -¡que nombrecitos, parecen inventados por Tip y Coll!- son precisamente esos elementos, si no se pueden tomar sus líneas espectrales?
domingo 26 marzo, 2017 @ 11:34 pm
Lluis, por eso precisamente hay disputas. «Tú no has descubierto eso, has descubierto otra cosa», que en realidad quiere decir yo lo descubrí antes y le pongo yo el nombre. La IUPAC se ha vuelto otro chiringuito plegado a los intereses sórdidos de siempre… Quizá en el siglo XXI cuando China tome la supremacía se propongan cambiar un montón de nombres, más que absurdos, completamente estúpidos. Siempre me llamó la atención de que los pocos elementos «descubiertos» (quiere decir aislados) por españoles ni siquiera les pusieron nombre (incluyendo el mexicano vanadio), no se molestaron en eso, con la excepción del platino, nombre popular y no otorgado por una comisión. Los británicos de finales del XVIII y principios del XIX ni se les pasó por la cabeza poner algo tan vulgar y chabacano como «Britanio», «Anglio», «Escotio» (aunque hay un Estroncio, pero es una historia curiosa)… era de mal gusto, científicamente hablando. Poco duró la cosa: Germanio, Rutenio, Polonio, Francio, Galio (doblete: el tipo se llamaba «gallo» en francés)… y luego ya el despiporre: Californio, Americio, Berkelio, Einstenio, Darmstadtio, Nihonio, Dubnio… no tenemos el Cocacolio ni el Searsroebuckio porque los niveles de vergüenza no estaban aún exhaustos.
Qué diferencia con Hidrógeno, Cloro, Indio (por el color, no el país), Cromo, Bromo, Nitrógeno, Silicio… es cierto que hay Magnesio, pero era porque sólo se obtenía allí. Hay una ciudad, Ytterby, que le da nombre a cuatro elementos.
A mí siempre me pareció bochornoso. Occidentalocéntrico a más no poder. Infantil total.
Largado el exabrupto, los elementos se identifican por las curvas que siguen en los aceleradores que los crean, viene siendo una especie de espectrografía de masas, y aparte que los modelos teóricos concuerdan. Pero efectivamente, hay casos disputados donde lleva su tiempo que se reconozca que ese isótopo es lo que su descubridor dice que es.
domingo 26 marzo, 2017 @ 11:36 pm
Sobre el artículo en sí, el helio precisamente fue descubierto en el Sol al comprobar que las líneas de emisión no coincidían con ningún elemento conocido (de ahí su nombre, precisamente). Aunque me temo que en este caso lo más probable es que estemos hablando de artefactos instrumentales. Claro que en caso contrario…
lunes 27 marzo, 2017 @ 12:06 pm
Sí, Dr. Thriller. De acuerdo, pero algunos elementos fueron descubiertos cuando aún no se habían inventado los aceleradores de partículas. Lo digo,como puedes imaginar por lo de las curvas que siguen los distintos elementos en esos aceleradores.
Un saludo, amigo.
lunes 27 marzo, 2017 @ 2:28 pm
Pero matizando un poco más mi comentario anterior, Dr.Thriller, lo que quise decir es que a partir de Fraunhofer, Kirchhoff y Bunsen, ya adviertieron que cada elemento posee un carcaterístico conjunto de líneas espectrales, y no existian aceleradores de partículas.
Abrazos.
lunes 27 marzo, 2017 @ 4:18 pm
Todos los elementos de Z<93 son estables y, salvo el tecnecio, están en la Tierra de alguna manera, por tanto son accesibles por medios químicos. Se los puede aislar sin mayores problemas. Pero el Tc y todos los transuránidos son sintéticos, y ya es otra película.
lunes 27 marzo, 2017 @ 4:25 pm
Matizando más también, las líneas espectrales son características de la corteza electrónica de cada átomo, es decir, los «saltos» cuantizados de energía de sus electrones entre estados fundamentales y excitados (átomos, iones, etc.). Como cada átomo tiene su configuración electrónica característica (que además es la causa de sus propiedades químicas), es fácil no sòlo identificar, sino incluso calcular el espectro de una especie química dada. Pero un átomo también tiene otras propiedades, sobre todo su núcleo: la masa y la carga. En ausencia de espectros electrónicos es suficiente para identificar un átomo (elementos diferentes pueden coincidir en la masa, pero no en la carga). Hay muchas más maneras, como RMN de spin nuclear, pero dada la brevedad de las detecciones imagino que se los identifica por la curva y la cascada de desintegración.
jueves 30 marzo, 2017 @ 4:38 pm
Hay que tener en cuenta que los espectros están desplazados por el efecto Doppler producido por la vibración y el movimiento de los átomo, además se entremezclan los espectros de diferentes elementos y moléculas